Термодинамический анализ применительно к технологии получения хромсодержащей лигатуры
А.С. Петрищев, С.М. Григорьев, И.В. Прус
Проведены расчеты равновесия в системе Cr-O-C и выполнен анализ термодина-мических закономерностей углеродотермического восстановления с участием в качестве восстановителя СО. Результаты анализа свидетельствуют о большой вероятности параллельного протекания реакций карбидообразования и малой вероятности получения безуглеродистого продукта в изучаемой системе. Полученные результаты являются теоретической основой для разработки методов утилизации хромсодержащего металлооксидного сырья при изготовлении хромсодержащих марок стали, где нет жестких ограничений по углероду.
Анализ публикаций по теме исследования
Развитие технологий порошковой металлургии позволило существенно повысить качество инструментальных сталей и дало толчок для разработки новых легирующих материалов [1,2].
Одна из распространенных технологий получения губчатых металлов состоит в восстановлении их с применением, как твердого углерода, так и его оксида в смеси с другими газами [3]. Формальный термодинамический анализ свидетельствует о предпочтительности реакций образования всех видов карбидов хрома в сравнении с реакцией получения хрома из оксида [4,5].
В настоящий период проблема доступности хромсодержащих материалов усугубляется отсутствием сырьевых источников на территории Украины, дефицит их восполняется импортными поставками при постоянном повышением цен на мировом рынке тугоплавких легирующих материалов [6-8].
Ситуация, которая сложилось с образующимися отходами и их переработкой, которая последует, характеризуется низкой степенью использования ценных дефицитных редких и тугоплавких элементов, а также отсутствием на практике надежных технологий их утилизации из техногенных отходов. Это, в свою очередь, снижает эффективность производства металлопродукции [9].
Формулировка целей статьи
Целью настоящей работы являлась разработка основных технологических параметров восстановления металлооксидных техногенных хромсодержащих отходов, а конкретные задачи этого этапа исследований заключались в углубленном изучении термодинамического равновесия соответствующих реакций в системе Cr-O-C при участии в качестве восстановителя монооксида углерода.
Основная часть
Для сравнительной оценки стойкости оксидов хрома и углерода в интервале температур 300-2000К были использованы данные термодинамических величин (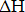 , S, Cp), которые взяты из справочников [10-14]. Для повышения точности расчетов использован метод Симпсона с учетом влияния изменения теплоемкости Ср материала с изменением температуры и влияние полиморфных преобразований исследуемых веществ на указанные выше термодинамические величины [15].
, S, Cp), которые взяты из справочников [10-14]. Для повышения точности расчетов использован метод Симпсона с учетом влияния изменения теплоемкости Ср материала с изменением температуры и влияние полиморфных преобразований исследуемых веществ на указанные выше термодинамические величины [15].
В системе Cr-O-C важная роль принадлежит монооксиду углерода СО как восстановителю, так как углерод в твердом состоянии имеет не идеальную поверхность контакта с восстанавливаемым оксидным сырьем, и интенсификация процесса возможна лишь при участии газообразного восстановителя. Появление монооксида углерода в исследуемой системе возможно как вследствие газификации углерода, так и в результате его образования в качестве продуктов реакции восстановления оксидов углеродом.
Изученные реакции восстановления оксидов хрома монооксидом углерода показывают, что наибольшую термодинамическую вероятность имеют реакции понижения высших оксидов хрома СrO3 и CrO2 до низших, например Cr2O3 (рис. 1).

1 - 2CrO2+CO=Cr2O3+CO2;
2 -2/3СrO3+CO=1/3Cr2O3+CO2;
3 - CrO3+CO=CrO2+CO2.
Рисунок 1 - Графики зависимости свободной энергии Гиббса реакций восстановления высших оксидов хрома до более низших при участии СО от температуры
Кривые данных реакций находятся в зоне значений свободной энергии Гиббса ниже -240 кДж. Причем реакции восстановления СrO3 до Cr2O3 имеют меньшую свободную энергию, чем в случае с восстановлением СrO2.
Из рис. 2 прослеживается четкая дифференциация оксидов хрома по склонности их к восстановлению монооксидом углерода.

Рисунок 2 – Графики зависимости свободной энергии Гиббса реакций восстановления оксидов хрома при участии СО от температуры
Наибольшую термодинамическую вероятность восстановления имеет триоксид хрома (рис. 2,в), причем свободная энергия Гиббса увеличивается от реакции восстановления до хрома металлического (кривая 12), затем до Cr23C6 (кривая 11), Cr7C3 (кривая 10) и до Cr3C2 (кривая 9). Кривые данных реакций в исследуемом температурном интервале расположены в отрицательной части диаграммы, принимая значения 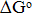 от -75 до -100 кДж.
от -75 до -100 кДж.
В исследуемом температурном интервале существования диоксида хрома CrO2 300-700К при восстановлении его монооксидом углерода (рис. 2,б), в отличии от CrO3, реакции с образованием карбидов (кривые 6-8) имеют меньшие значения свободной энергии Гиббса (-10..-30кДж), чем кривая реакции восстановления до хрома металлического (кривая 5) – от 0 до 10 кДж.
Наиболее стойкий к восстановлению монооксидом углерода – Cr2O3 (рис. 2,а). Кривые реакций зависимости свободной энергии Гиббса от температуры находятся в положительной части графика в интервале от 10 до 100 кДж. Термодинамическая вероятность восстановления уменьшается от кривой 4 с образованием Cr3C2, затем до кривых 3 и 2 с образованием Cr23C6 и Cr соответственно. Наибольшее значение свободной энергии Гиббса имеет реакция 1 с образованием Cr7C3 в качестве продукта реакции.
Данные на рис. 2 свидетельствует об очень близкой по своему значению вероятности протекания реакций карбидообразования и восстановления в системе Cr-O-C при участии в качестве восстановителя монооксида углерода.
Использование хромсодержащей лигатуры, на основе восстановленного углеродотермическим способом металооксидного сырья, с содержанием ведущего элемента 35,5% (по массе) при выплавке инструментальной стали 40ХЛ в дуговой печи ДСП-3 с основной футеровкой методом переплава с основной футеровкой методом переплава нелегированных отходов трубного производства не вызывает технологических трудностей. Металлокарбидная форма присутствия основных элементов хрома и железа с избыточным остаточным содержанием углерода (4,5-6,5% по массе) обеспечивает усвоение хрома расплавом стали более 95%, что выше по сравнению с использованием со стандартным феррохромом марок ФХ650 и ФХ800 (88-92%).
Выводы
Анализ реакций восстановления оксидов хрома монооксидом углерода в системе Cr-O-C позволяет предположить, что реакции восстановления окиси хрома до карбидов являютcя доминирующими. В интервале температур 300-2000К значения энергии Гиббса образования хрома металлического и карбидов хрома типа CrnCm очень близки по своим абсолютным значениям и получить безуглеродистый продукт в этой системе весьма маловероятно. Участие газовой фазы СО в качестве восстановителя параллельно С, является результирующим, так как обеспечивает большую поверхность контакта реагирующих веществ. Необходимо учитывать влияние внешних факторов на вероятность протекания восстановительных процессов в исследуемой системе. Расчеты свидетельствуют, что РсоРатм., и являются одним из факторов влияния на равновесие реакций восстановления.
Промышленные испытания получения металлизованного хрома в гетерогенной системе свидетельствуют о том, что в целевом продукте остаточный углерод присутствует в виде карбидов хрома типа CrnCm. Использование хромсодержащих брикетов в качестве легирующей добавки при выплавке стали не имеет технологических затруднений и может применяться наряду со стандартным феррохромом.
Список литературы
- Порошковая металлургия. Спеченные и композиционные материалы / Под ред. В. Шатта; Пер. с нем. - М.: Металлургия, 1983. - 520 с.
- Григорьев С.М. Повышение качества металлизованного молибденового концентрата // Сталь. - 1993. - №3. - С. 39-44.
- Получение металлизованного молибденового концентрата из брикетированной шихты и его использование при выплавке стали / С.М. Григорьев, В.Б. Акименко, А.Н. Попов, П.Н. Острик и др. // Сталь. - 1983. - №8. - С. 79-81.
- Попов А.А., Острик П.Н., Гасик М.М. Термодинамика восстановления и карбидо-образования в системе Cr-O-C // Изв. Вузов. Черная металлургия. - 1986. - №10. - С. 2-4.
- Кинетические закономерности комбинированного восстановления оксидных систем Fe-Cr-O и Fe-Ni-Cr-O / А.А. Попов, П.Н. Острик, И.В. Волков и др. // Изв. вузов. Черная металлургия. - 1987. - №8. - С. 1-4.
- Адно Ю. Л. Структурная перестройка экономики и проблемы развития черной металлургии // Сталь. – 1994. - №12. – С. 1-6.
- Синельников В. А. Отраслевая наука черной металлургии в условиях рынка // Сталь. – 1994. - №8. – С. 6-8.
- Mike O'Driscoll .Chromite in crisis // Industrial minirals. – February 1999. – p. 25-33.
- Григорьев С. М. Экономическая стратегия и тактика ресурсо- и энергосбережения в металлургии тугоплавких материалов // Сб. “Металургия”. Выпуск 1. – Запорожье: ЗГИА. – 1998. – С. 17-23.
- Физико-химические свойства окислов. Справочник. Самсонов Г.В., Борисова А.Л., Жидкова Т.Л и др. – М.: Металлургия, 1978. – 472 с.
- Самсонов Г.В. Тугоплавкие соединения (справочник). – [2-е изд.]. – М.: Металлургия, 1976. – С.176.
- Киреев В.А. Методы практических расчетов в термодинамике химических реакций. – М.: Химия, 1970. – С. 328.
- А.Н. Крестовников, Л.П. Владимиров, Б.С. Гуляницкий, А.Я. Фишер. Справочник по расчетам равновесий металлургических систем . – М.: Государственное научно-техническое издание литературы по черной и цветной металлургии, 1963. - С. 356.
- Куликов. И.С. Термодинамика оксидов: справ. изд. – М.: Металлургия, 1986. – С.137.
- Термодинамический анализ и математическое моделирование применительно к технологии получения губчатого вольфрама / М.С. Карпунина, А.С. Москаленко, С.М. Григорьев и др. // Сталь. - 1999. - №11. - С. 33-36.
Рецензент д.т.н., проф. А.Н. Смирнов
© А.С. Петрищев, С.М. Григорьев, И.В. Прус
